醫(yī)療器械注冊人制度是當今國(guó)際社會醫(yī)療器械領域的通行管理(lǐ)制度,是貫穿醫(yī)療器械全生命周期的基本法律制度,在我國(guó)該項制度正處于積極推進和廣泛落實的進程當中[1]。2021 年6 月1 日,新(xīn)版《醫(yī)療器械監督管理(lǐ)條例》實施,标志(zhì)着醫(yī)療器械注冊人制度正式在全國(guó)範圍内推行,因此迎來更多(duō)新(xīn)的機遇和變革。湖(hú)南省政府、藥監部門、醫(yī)療器械行業協會、企業等順勢而為(wèi)、多(duō)方努力協作(zuò),使得省内醫(yī)療器械産業進入蓬勃發展時期,外省許多(duō)大型醫(yī)療器械企業紛紛選擇在湖(hú)南建立分(fēn)公司,主要負責為(wèi)持有醫(yī)療器械注冊證的母公司從事生産活動,或者直接選擇受托企業委托生産,同時不少受托平台和第三方服務(wù)機構也應運而生。為(wèi)進一步加強對醫(yī)療器械注冊人委托生産的管理(lǐ),切實保障醫(yī)療器械産品質(zhì)量安(ān)全,湖(hú)南省藥品監督管理(lǐ)局于2023 年組織開展醫(yī)療器械注冊人委托生産專項檢查。本文(wén)結合該項工作(zuò)實踐,統計了其中244 家注冊人企業和受托生産企業的檢查情況,通過分(fēn)析我國(guó)醫(yī)療器械注冊人制度建設進程和本省注冊人委托生産現有形勢,梳理(lǐ)出檢查過程中存在的問題并展開探讨,提出改進建議,以促進醫(yī)療器械産業高質(zhì)量發展。新(xīn)修訂的《醫(yī)療器械監督管理(lǐ)條例》[2](國(guó)務(wù)院令第739号)于2020 年12 月21 日國(guó)務(wù)院第119 次常務(wù)會議修訂通過,自2021 年6 月1 日起施行,其中正式設立了注冊人制度,此項改革的意義深遠(yuǎn)且重大:①将構建一個貫穿醫(yī)療器械産品全生命周期的責任主體(tǐ),使其承擔對産品質(zhì)量自始至終的管理(lǐ)義務(wù);②将疏通産品注冊與生産管理(lǐ)壁壘,破除産品上市許可(kě)和生産許可(kě)的捆綁關系;③将實現行業資源的合理(lǐ)配置,刺激行業研發投入增加,達到推動行業創新(xīn)發展的目的[3]。2022 年5 月1 日施行的《醫(yī)療器械生産監督管理(lǐ)辦法》[4],為(wèi)配套注冊人制度的實施,做了相應修訂,主要體(tǐ)現在以下幾方面:①注冊人和受托生産企業應建立質(zhì)量管理(lǐ)體(tǐ)系并保持其有效運行,以此來保證醫(yī)療器械生産活動正常開展;②明确注冊人對其生産的醫(yī)療器械質(zhì)量安(ān)全全面負責,并要求确保設計開發輸出适用(yòng)于生産;③規定注冊人和委托生産企業雙方職責、權利和質(zhì)量保證有關措施;④對自行生産和委托生産這兩種情況的監管重點進行區(qū)分(fēn);⑤明确跨區(qū)域委托生産的監管職責分(fēn)工、以及開展協同監管的方式和要求。2022 年3 月,國(guó)家藥監局發布了《醫(yī)療器械委托生産質(zhì)量協議編制指南》[5],指導醫(yī)療器械注冊人、備案人與受托生産企業共同做好醫(yī)療器械委托生産質(zhì)量管理(lǐ)工作(zuò)。2022 年4 月,國(guó)家藥監局發布了《關于加強醫(yī)療器械跨區(qū)域委托生産協同監管工作(zuò)的意見》,通過采取加強注冊核查、監督檢查、結果處置、抽檢、不良事件監測、監管協同配合、監管信息互聯互通、嚴肅查處違法違規行為(wèi)這八種方式,使得職責權限清晰、信息交流準确高效、工作(zuò)銜接流暢、協作(zuò)監管效能(néng)加倍,确保在注冊人制度全面實施過程中監管工作(zuò)有序有效進行[6]。2022 年6 月,國(guó)家藥監局發布了《支持港澳醫(yī)療器械注冊人在大灣區(qū)内地9 市生産醫(yī)療器械實施方案》,允許港澳醫(yī)療器械注冊人跨境委托生産,推動粵港澳大灣區(qū)醫(yī)療器械産業深度融合,相互借鑒助力,實現共同發展[7]。2022 年10 月,《醫(yī)療器械注冊質(zhì)量管理(lǐ)體(tǐ)系核查指南》[8](以下簡稱《指南》)發布。在注冊人委托生産過程中,委托協議、設計轉換、技(jì )術文(wén)件轉化和工藝驗證、技(jì )術轉化風險控制、溝通機制這些方面,與注冊人自行生産的情況有較大區(qū)别。該《指南》針對注冊人制度下的委托生産作(zuò)出專門規定,對醫(yī)療器械全生命周期各個環節的核查要點進行詳細闡述,提高了注冊核查工作(zuò)質(zhì)量。
2023 年7 月,國(guó)家藥品監督管理(lǐ)局公開征求《關于進一步加強醫(yī)療器械注冊人委托生産監管工作(zuò)的意見(征求意見稿)》[9] 意見,其中針對注冊人制度全面實施過程中存在的突出問題給出建議,如:注冊人質(zhì)量安(ān)全主體(tǐ)責任落實,質(zhì)量協議管理(lǐ)的适宜性、充分(fēn)性、有效性,不良事件責任義務(wù),注冊證管理(lǐ),生産變更管理(lǐ)及風險控制,注冊人退出管理(lǐ)機制,生産信息互通,創新(xīn)監管方式方法等,通過一系列措施來防控醫(yī)療器械委托生産風險隐患。
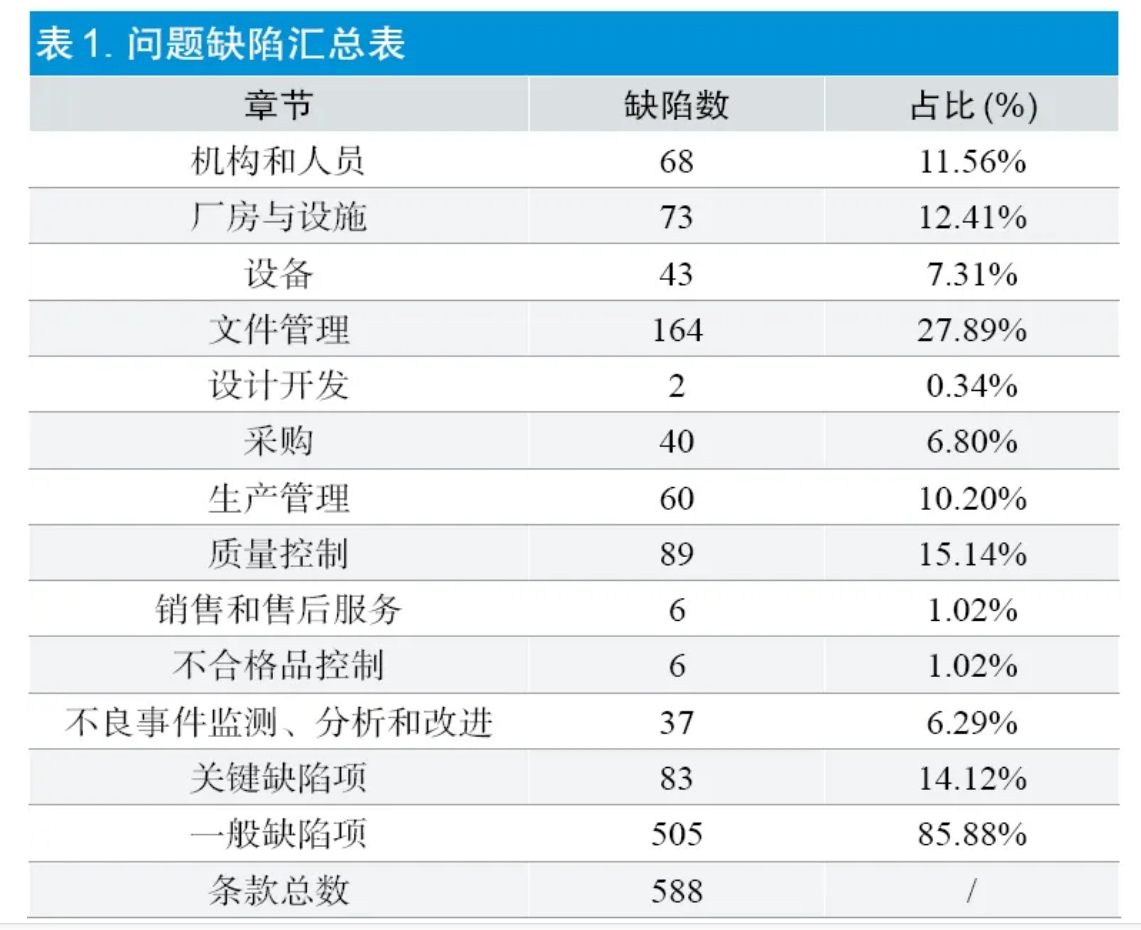
本項研究工作(zuò)是以《醫(yī)療器械監督管理(lǐ)條例》《醫(yī)療器械生産監督管理(lǐ)辦法》《醫(yī)療器械生産質(zhì)量管理(lǐ)規範》(及其附錄)《醫(yī)療器械生産質(zhì)量管理(lǐ)規範現場檢查指導原則》為(wèi)依據開展檢查,涉及長(cháng)沙市地區(qū)、湖(hú)南省醫(yī)療器械産業園的注冊人企業、受托生産企業和平台公司,總共244 家,派出檢查人員535 人次,發現問題缺陷588 項。将所有缺陷歸屬到《醫(yī)療器械生産質(zhì)量管理(lǐ)規範現場檢查指導原則》中11個章節中,占比前三名分(fēn)别是文(wén)件管理(lǐ)27.89%、質(zhì)量控制15.14%、廠房與設施12.41%,直接影響産品質(zhì)量和安(ān)全的關鍵缺陷項占比14.12%,具體(tǐ)情況如表1 所示。
在檢查過程中還發現了諸多(duō)其他(tā)問題和隐患。
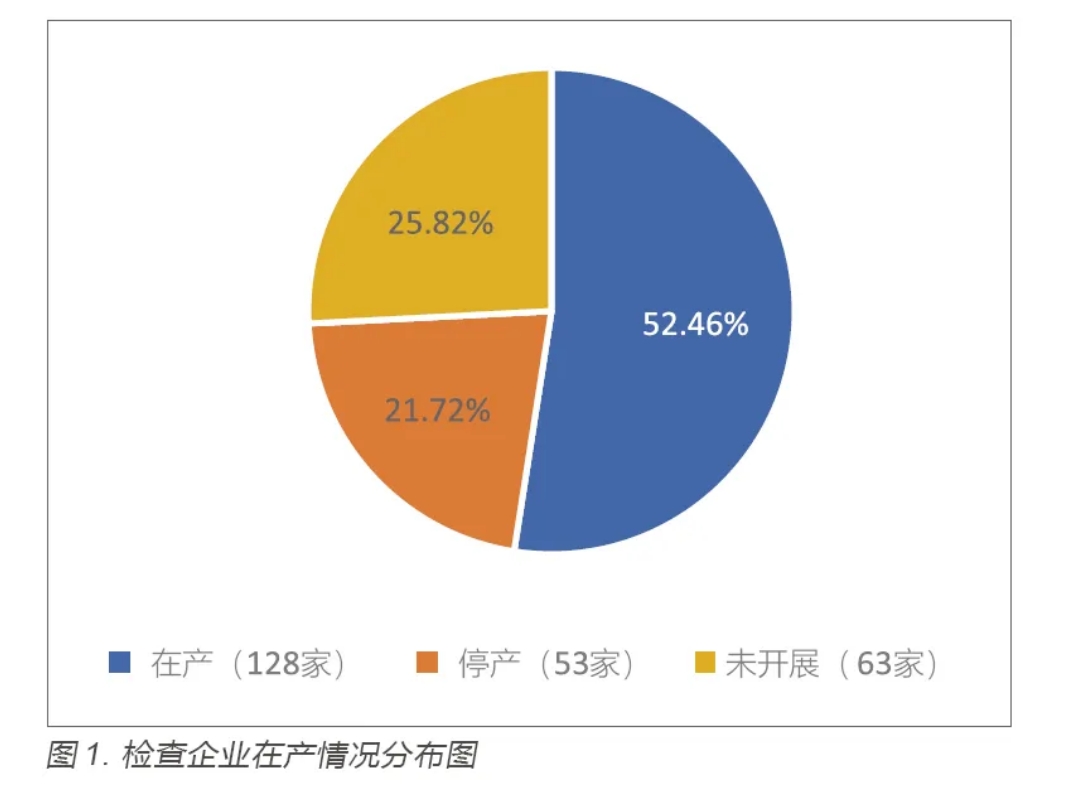
首先,在産企業占比較少,從“拿(ná)證”到産業化轉化率不高。244 家企業中,檢查時無人員,未開展檢查的63 家,停産53 家,在産128 家,分(fēn)布情況如圖1 所示。開展檢查的企業中,平均每家發現缺陷3.25 項。在産128 家企業中,所有受托生産企業均按要求開展生産放行,2 家注冊人未按要求開展上市放行。
第二,新(xīn)獲證企業管理(lǐ)經驗和生産經驗不足,責任意識和風險意識有待加強。244 家企業中,75 家企業于2023 年新(xīn)獲取醫(yī)療器械注冊證,在創業初期,設施設備有待完善,注冊人和受托生産企業之間、企業内部人員管理(lǐ)均需要時間磨合、充分(fēn)溝通,生産技(jì )術、操作(zuò)技(jì )能(néng)需要不斷實踐練習,尤其是研發型注冊人對産品生産工藝的認識和理(lǐ)解限于研發規模,缺乏大批量産經驗,監督受托生産企業履行生産責任的能(néng)力不足,且其質(zhì)量體(tǐ)系控制能(néng)力同樣值得商榷,在本身體(tǐ)系不完善的情況下,研發型注冊人難以對受托方進行全面的技(jì )術培訓,導緻受托方無法全面理(lǐ)解産品生産工藝、技(jì )術要求等相關知識,造成委托方和受托方的品質(zhì)控制差異大[1]。
第三,平台公司受托生産的注冊人産品品種數目較多(duō),存在生産能(néng)力不足,交叉污染等風險。在此項研究中,平台公司受托生産品種多(duō)的為(wèi)477 個,該公司建築面積9200餘平方米,生産面積2300 餘平方米,檢驗面積500餘平方米,倉庫總面積1200 餘平方米,現有員工20 餘人,承接生産診斷試劑類産品,無自主研發産品。雖然診斷試劑類産品生産工藝、檢驗流程類似,廠房設施設備能(néng)共用(yòng),但在受托生産品種數過多(duō)的情況下,對文(wén)件轉換接收、人員培訓、原材料出入庫管理(lǐ)、生産場地清場、成品驗收和放行等都提出了更嚴苛的要求,要做到人員操作(zuò)有據可(kě)依、條理(lǐ)清楚,記錄清晰明了、準确翔實,場地分(fēn)區(qū)明确,布局合理(lǐ),資料一一對應、保密管理(lǐ)。該公司僅20 餘人,其自身質(zhì)量管理(lǐ)和生産能(néng)力與受托生産品種數存在明顯不匹配,風險較高。
第四,湖(hú)南省藥品監督管理(lǐ)局對1 家企業發出責令整改通知書,該企業存在未配備管理(lǐ)者代表、未設置獨立的辦公場所、未提供注冊産品的工藝規程、檢驗規程等技(jì )術文(wén)件及注冊資料、無法保持質(zhì)量管理(lǐ)體(tǐ)系有效運行等問題,責令該企業停産整改。
所有開展檢查的企業均存在問題,主要發生在文(wén)件管理(lǐ)、質(zhì)量控制、廠房與設施這幾個方面。對企業提出以下幾點建議:①注冊人和受托生産企業應自覺提高責任意識和擔責能(néng)力。注冊人委托生産應實行以注冊人為(wèi)主體(tǐ)責任的“生産放行+上市放行的雙放行”制度,建立“雙管代”制度,受托生産企業向注冊人提供委托過程中必要的質(zhì)量數據和發現的醫(yī)療器械不良反應事件或可(kě)疑不良事件,并配合注冊人進行不良事件的監測、分(fēn)析和改正[10]。②更新(xīn)完善硬件設施,以滿足生産檢驗的要求。檢驗設備不足或老舊是很(hěn)多(duō)企業的通病,盲目提升産能(néng),追求經濟效益,忽略質(zhì)量和安(ān)全是産品的生命線(xiàn)。企業應随着産品叠代升級、生産規模擴大、技(jì )術要求更新(xīn)來配備相适應的檢驗設備,保證質(zhì)量控制水平同步增長(cháng)。③注重培養員工專業素質(zhì)和能(néng)力,加強學(xué)習;通過高校招收醫(yī)療器械相關專業人才;構建和宣傳企業文(wén)化,增強員工歸屬感和成就感。多(duō)渠道整體(tǐ)提升企業軟實力。④在文(wén)件管理(lǐ)和轉換方面,企業可(kě)以借鑒監管部門、行業協會發布的指導原則、指南、标準等規範性文(wén)件,如:《醫(yī)療器械委托生産質(zhì)量協議編制指南》《醫(yī)療器械質(zhì)量管理(lǐ)體(tǐ)系年度自查報告編寫指南》《 醫(yī)療器械 環氧乙烷滅菌确認和常規控制》等,使其自身體(tǐ)系文(wén)件更加精(jīng)準适用(yòng)。
針對“拿(ná)證多(duō),在産少”的情況,建議采取以下舉措,促使醫(yī)療器械産品盡快“落地”:①政府制定出台醫(yī)療器械産業專項配套政策,重點在資金、稅收、人才、産品研發注冊等方面,同時保持已有政策的延續性和穩定性。②依托行業龍頭企業和相關監管部門、行業協會,積極引進和培育醫(yī)療器械類公共服務(wù)平台,為(wèi)初創企業提供資金、醫(yī)療器械研發、産品注冊、生産經營等全周期服務(wù),增強其行業服務(wù)功能(néng)[11]。③企業應加強與相關高校等研究機構的合作(zuò),吸引人才加入,大力發展創新(xīn)型醫(yī)療器械産品,提高産品競争力,推動産學(xué)研結合[12]。本項研究工作(zuò)中,檢查時無人或停産企業共116 家,涉及檢查人員250 餘人次,這些企業均未有效生産,開展檢查的實際作(zuò)用(yòng)不大,浪費了監管資源。針對此類情況,監管部門應在檢查前統計好企業停産、注銷、地址變更等信息,避免無功而返;對企業複産、注冊證/ 許可(kě)證延續、變更等情況給予指導和幫助,優化審批流程,提升審批質(zhì)效;對長(cháng)期停産、無人、質(zhì)量管理(lǐ)體(tǐ)系存在嚴重問題、風險系數極高的企業,應積極督促整改或注銷清查。
來源:中國(guó)醫(yī)療器械信息

